
Läkemedelsutveckling – Utmaningarna
I den första delen av BioStocks artikelserie om läkemedelsutveckling bekantade vi oss med de olika stegen i den långa resan från upptäckt av en ny substans till det att ett färdigutvecklat läkemedel når marknaden. I denna andra artikel i serien belyser vi de utmaningar som det läkemedelsutvecklande bolaget möter, och hur de kan skilja sig åt beroende på terapeutiskt fokus.
Att utveckla ett nytt läkemedel omfattar substansupptäckt, preklinisk och klinisk utveckling samt tillhörande regulatoriska processer. Om allt går enligt plan och det läkemedelsutvecklande bolaget därefter har tillräckligt god bevisning för sin kandidats säkerhet och effekt, så lämnas en ansökan om regulatoriskt godkännande in hos berörda myndigheter i respektive geografisk region – till exempel FDA i USA och EMA i Europa.
Läs även:
Läkemedelsutveckling del I – De fyra stegen
Läkemedelsutveckling del III – En regulatorisk hinderbana
Läkemedelsutveckling del IV – Att göra behandlingar tillgängliga
Läkemedelsutveckling del V – Framgången med särläkemedel
Regulatoriska riktlinjer ställer höga krav
Att erhålla regulatoriskt godkännande för varje utvecklingssteg kräver att man följer de strikta riktlinjer och höga standarder som råder (GVP, GLP etc.), inte minst avseende läkemedelskandidatens säkerhet och effekt. Det rigorösa regelverket gör naturligtvis utvecklingsprocessen komplex, samtidigt som det finns till för att processen ska vara säker. Utmaningen att uppnå de höga regulatoriska kraven är en starkt bidragande faktor till två andra utmaningar – nämligen tids- och kostnadsbördorna förknippade med läkemedelsutveckling.
Kostnaden – den största utmaningen
Utöver att identifiera en substans med önskvärd verkningsmekanism och den långa tid det tar att utveckla ett läkemedel, så är den enskilt största utmaningen med läkemedelsutveckling de höga kostnaderna.
En studie publicerad i JAMA av Wouters et al. 2020 uppskattade mediankostnaden för att utveckla ett nytt läkemedel till 985 miljoner USD. Studien inkluderade data för 63 läkemedel som godkändes av FDA mellan år 2009 och 2018, varav de flesta erhöll marknadsgodkännande mellan 2014 och 2018. Datan avsåg huvudsakligen läkemedel utvecklade av mindre bolag, särläkemedel (läkemedel riktade mot sällsynta sjukdomar) och First-in-Class-läkemedel (läkemedel med ny eller unik verkningsmekanism).
Samma studie visar också att kostnaderna skiljer sig mellan olika terapeutiska områden. Exempelvis uppskattades mediankostnaden för att utveckla ett läkemedel inom neurologiska indikationer till 766 miljoner USD, medan motsvarande prislapp för onkologi- och immunologiska läkemedel var 2772 miljoner USD. Detta då en större andel onkologi- och immunologiska läkemedelsprojekt misslyckas innan de når marknaden.
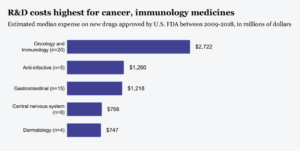 Data från “Estimated Research and Development Investment Needed to Bring a New Medicine to Market, 2009–2018,” JAMA
Data från “Estimated Research and Development Investment Needed to Bring a New Medicine to Market, 2009–2018,” JAMA
JAMA-studien kan ställas i relation mot en tidigare studie av DiMasi et al. som undersökte utvecklingskostnaderna för 106 nya läkemedel framtagna av tio stora läkemedelsbolag. DiMasi et al. kom fram till att den genomsnittliga kostnaden för läkemedelsutveckling uppgick till 2.8 miljarder USD, alltså i samma härad som priset för att ta fram onkologi- och immunologiska läkemedel enligt Wouters et al. Sannolikt återspeglar den högre kostnadsuppskattningen att det faktum att globala läkemedelsbolag har möjlighet att utföra större och kostsammare kliniska studier än mindre bolag, vilket också genererar mer robust data gällande säkerhet och effekt.
Billigare att utveckla särläkemedel, men kan ta längre tid
Vill man förkovra sig ytterligare i olika typer av läkemedel, så finns det en vedertagen uppfattning om att utveckling av särläkemedel är mindre utmanande p.g.a. både billigare och snabbare utveckling än den för läkemedel utan särläkemedelsstatus. En studie av Jayasundara et al. tittade närmare på detta i syfte att uppskatta och jämföra kostnaden för särläkemedel och icke-särläkemedel. Studien drog slutsatsen att kostnaden för att utveckla ett särläkemedel var lägre, men att utvecklingen tog betydligt längre tid. Sannolikt kan båda dessa aspekter härledas till den begränsade patientpopulationen. Bolag som utvecklar särläkemedel kan nämligen få tillstånd att inkludera färre patienter i sina kliniska studier, vilket sänker kostnaderna. Men trots detta kan det uppstå utmaningar med att rekrytera patienter från den begränsade patientgrupp som en sällsynt sjukdom per definition har.
Få når hela vägen till marknaden
Åter till det faktum att läkemedelsprojekt kan misslyckas innan de når marknaden – hur ser egentligen riskerna med läkemedelsutveckling ut? Faktum är att långt ifrån alla läkemedelskandidater erhåller ett slutligt marknadsgodkännande – snarare tvärtom. I boken Biotech Valuation: A playbook for dealmakers av Thornblad & Carlsson framgår att sannolikheten att nå marknadsgodkännande – eller Likelihood of approval (LoA) – endast är 12 procent för läkemedelsprojekt som befinner sig i fas I.
Siffran stiger till 18,8 procent i fas II och 55,1 procent i fas III. Utöver att siffrorna är en tydlig indikation på hur osäkert utfallet är i varje studiesteg så visar de alltså att hälften av alla kandidater i fas III inte uppnår regulatoriskt godkännande. De redovisade sannolikheterna illustrerar den signifikanta risken som är förknippad med läkemedelsutveckling.
I sammanhanget är det också värt att notera att inte ens alla regulatoriskt godkända läkemedel når marknadslansering. Faktum är att hela 15 procent av de godkända läkemedlen inte gör det. Detta beror på att även om myndigheterna bedömer att läkemedlet är effektivt och säkert, så måste det också passa in i vårdkedjan och efterfrågas av professionen. Ett annat hinder för lansering kan vara att det färdiga läkemedlet köps upp av en konkurrent i syfte att bibehålla kontroll över marknadssegmentet, och därefter slopas och hindras från marknadsentré.
Fler utmaningar i korthet
En annan utmaning inom läkemedelsutveckling är patientrekryteringen till kliniska studier. Att rekrytera tillräckligt många patienter – och därmed generera statistiskt signifikanta data – är både mycket tidskrävande och kostsamt. Därtill finns flera andra faktorer som påverkar tiden och kostnaden för läkemedelsutveckling – såsom design av kliniska studier, val av läkemedelsformulering, utfallsmått och dataanalys. Det rigorösa regelverk som styr läkemedelsutvecklingen utgör också betydande utmaningar för bolagen. Detta regelverk kommer att stå i fokus för nästa artikel i denna serie.



