Stamcellsbolaget Amniotics står inför notering och kliniska prövningar i andningssjukdomar
Amniotics samlar in stamceller från fostervatten för att framställa vävnadsspecifika stamcellsterapier för behandling av en rad olika sjukdomar, exempelvis det livshotande lungtillståndet ARDS som bland annat drabbar svårt sjuka covid-19-patienter. Nu står bolaget inför en notering på Nasdaq First North Growth Market samt en första klinisk studie med den lungspecifika kandidaten PulmoStem. BioStock kontaktade Amniotics vd Kåre Engkilde för att få veta mer om bolagets stamcellsterapier och den kommande marknadsnoteringen.
![]() Amniotics är ett biofarmaceutiskt bolag som utvecklar stamcellsterapier för behandling av inflammatoriska och fibrotiska sjukdomar som saknar effektiv behandling.
Amniotics är ett biofarmaceutiskt bolag som utvecklar stamcellsterapier för behandling av inflammatoriska och fibrotiska sjukdomar som saknar effektiv behandling.
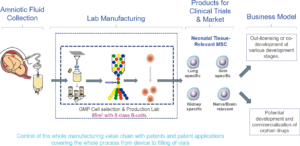
Bolaget samlar in mesenkymala stamceller från fostervatten vid planerade kejsarsnitt med hjälp av en CE-märkt medicinteknisk produkt. Därefter används en särskild metod för att framställa stamceller som är vävnadsspecifika, vilket innebär att de är anpassade för vissa vävnader eller organ, exempelvis lungor, hjärna, hud och njure.
Mesenkymala stamceller regenererar ny vävnad
Sedan tidigare är det känt att mesenkymala stamceller har anti-inflammatoriska, regenerativa och anti-fibrotiska egenskaper, och Amniotics arbetar efter hypotesen att neonatala och vävnadsspecifika stamceller har ännu bättre terapeutiska effekter. Stamcellerna produceras i Amniotics egna GMP-anläggning (Good Manufacturing Practice) i Lund som färdigställdes och godkändes under 2020.
Bolaget har en unik framställningsmetod som används för att utveckla och ta fram stamcellsterapier för behandling av flera olika sjukdomar. I dagsläget består produktportföljen av fyra vävnadsspecifika stamcellsprodukter; PulmoStem för lungindikationer, CogniStem för sjukdomar i CNS, NephroStem för njurspecifika indikationer samt CutiStem för dermatologiska användningsområden.
PulmoStem är Amniotics ledande kandidat
Amniotics ledande kandidat är PulmoStem som riktar sig till patienter med lungsjukdomar där fibros (ärrbildning) och inflammation är nyckelkomponenter, exempelvis Acute Respiratory Distress Syndrome (ARDS), idiopatisk lungfibros (IPF) och akut organavstötning i samband med lungtransplantation. Nu planerar bolaget för en första klinisk fas I/II-studie med PulmoStem i en lungsjukdom med inflammatoriska och fibrotiska komponenter. Studien förväntas initieras under första halvåret 2022 och det primära syftet är att visa att produkten är säker och tolereras väl, men också att via biomarkörer få indikation på klinisk effekt.
Amniotics har även ett antal andra intressanta stamcellsprodukter i sin utvecklingsportfölj som befinner sig i ett tidigt skede och som beräknas komma in i klinisk fas under de kommande åren.
Fokus på patienter med ARDS och Covid-19 utlöst ARDS
ARDS är ett akut inflammatoriskt tillstånd som skapar svåra andningsproblem och som oftast kräver respiratorvård. Covid-19-pandemin har lett till en ökning av antalet patienter med ARDS eftersom de allvarligaste fallen av covid-19 utvecklar ARDS.
I dagsläget finns i stort sett inga effektiva behandlingar mot ARDS på marknaden. I och med det stora medicinska behovet har Amniotics valt att initialt rikta sitt fokus mot denna patientgrupp. Mesenkymala stamceller har visat lovande resultat i covid-19-patienter med ARDS, och Amniotics tror att PulmoStem kan ge ännu bättre resultat då kandidaten är specifikt framtagen för just lungvävnad. PulmoStem förväntas minskacytokinstormen som är förknippad med covid-19 och dessutom regenerera den skadade vävnaden.
Amniotics vd Kåre Engkilde berättar mer

BioStock kontaktade Amniotics vd Kåre Engkilde för att få veta mer om bolagets stamcellsterapier, noteringen på Nasdaq First North Growth Market och planerna framåt.
First of all, would you like to tell us briefly about yourself and your professional background?
– I’m coming with a background from R&D and has worked in both discovery, pre-clinical and clinical development from both small biotech and big pharma. Hence, I’m driven towards development of life-changing therapies, with a strong focus on regulatory path and ensuring a focus on CoGs and return of investment.
Could you describe Amniotic’s journey, from the research behind the company to where it is today?
– Amniotics was founded by three clinicians and scientists and is based on a decade of research at Lund University Stem Cell Center and Hospital. The first steps were observing that there were stem cells in the amniotic fluid and designing a device to collect amniotic fluid. Later the building of a GMP facility for production and development of the pipeline has taken place.
How does your stem cell therapy stand out from other stem cell treatments and what are the main benefits of tissue-specific stem cells from amniotic fluid?
– We have a focus on tissue-specific or relevant mesenchymal stem cells (MSCs) from amniotic fluid. The fluid is a medical waste and not used, and therefore there are no ethical or medical issues in collecting it. By taking the fluid directly from C-sections, the oxygenation and aseptic conditions are kept. Later the cells for various tissue specificities are selected. Finally, as our pipeline is based on neonatal quality tissue specific MSCs, we expect our products to have better cellular therapy efficacy than cells taken from adults with no tissue specificity.
»As our pipeline is based on neonatal quality tissue specific MSCs, we expect our products to have better cellular therapy efficacy than cells taken from adults with no tissue specificity. «
Can you give us a brief overview of the entire production process, from the collection of stem cells to the final product?
– The amniotic fluid is collected at planned C-sections in a safe and uncomplicated procedure that takes roughly 90 seconds. Later the fluid is transported to Amniotics GMP approved facility where we separate the cells and apply selection methods to identify and collect MSCs for various tissue-specific products (PulmoStem, CogniStem, CutiStem & NephroStem). These steps are followed by a propagation of the cells to expand the number of cells, before they are filled into vials and frozen at -150C for clinical trials in life-changing diseases.
– Hence, one could say it is from life to life.
What is the timetable and study design for the upcoming clinical study with PulmoStem?
– Regarding PulmoStem we are focusing on indications of high medical need where there is inflammatory and fibrotic components associated with the respiratory indications. Generally, we are working on adaptive trial design in order to work with speed.
What indications do you plan to focus on with Amniotics’ other candidates – CogniStem, NephroStem and CutiStem – and when do you think you will initiate clinical studies in these indications?
– We expect the next pipeline product for clinical trials will be CogniStem for CNS/neuronal indications and later we will further expand with products in clinical trials to diversify the pipeline. I expect that our CogniStem clinical trials will be initiated in 2022 or 2023.
What does the company’s patent situation look like?
– Amniotics has a strong IP portfolio, with IP covering the different steps of our manufacturing processes and development creating a strong coverage of the whole value chain.
In 2020, you received manufacturing permission from the Medical Products Agency for your GMP facility. What benefits do you see from having your own GMP facility?
– Having our own production facility with GMP approval gives us a good control and enables us to produce our products in time for clinical trials. Also, this will give us the opportunity of adding an early revenue stream from taking in assignments from others with need for production of cell-therapeutics or ATMPs, this as we have built a facility with capacity to run several products in parallel.
»Having our own production facility with GMP approval gives us a good control and enables us to produce our products in time for clinical trials.«
You are now entering First North. Why do you choose to carry out an IPO right now?
– We have developed a high-quality project portfolio, and for us to be able to continue and take the next steps and drive development forward, more resources will be required such as competent employees, equipment, patents to name a few.
How will you use the capital you will raise in connection with the listing?
– The major portion of the proceeds will be used for clinical development/trials, and some will be used for further expansion of Amniotics development and non-clinical studies.
Finally, where do you see Amniotics in five years?
– In five years’ time I see Amniotics as a strong contributor in the field of cell therapeutics. With strong partnership across the globe, and being well underway with gaining conditional approval in Japan, and having initiated studies in US.
Artikelns innehåll är sponsrat av det aktuella bolaget som förekommer i texten. BioStock tillhandahåller inte investeringsrådgivning, förmedlar inga investeringsorder och tar inget ansvar för agerande och/eller eventuell förlust eller skada av något slag som grundar sig på användandet av innehåll som publicerats på BioStock.se. Varje investeringsbeslut fattas istället självständigt av den enskilde investeraren.