
Alligators ATOR-1015 – tre nobelpris i en molekyl
Aktiviteten i immunonkologibolaget Alligator Bioscience har varit hög det gångna året. Parallellt med ett intensivt nyhetsflöde, där studiestarten med huvudprojektet ATOR-1015 sticker ut, har en mångmiljonintäkt kunnat bokföras från Sydkorea. Dessutom har två av årets nobelpris en direkt koppling till bolagets huvudprojekt, vilket lär ha synliggjort bolaget ytterligare på den internationella branschradarn. Nedan berättar Alligators vd Per Norlén mer om det gångna året och vad som väntar under 2019.
Alligator Bioscience verkar inom ett fält som visserligen är konkurrensutsatt, men som också prognostiseras bli mycket lukrativt under överskådlig framtid. Efter att ha licensierat ut ADC-1013 till världens största läkemedelsbolag Johnson & Johnson – en affär potentiellt värd 6 miljarder kronor – är Lundabolaget nu på god väg att kunna ståta med huvudsakligen kliniska projekt i pipeline.
»Kan vi visa att vårt koncept håller i kliniken kan man se försäljning på 1 miljard dollar som en bas, men med en potential som är långt större« — Per Norlén, vd Alligator Bioscience
Den 11 december i år inleddes bolagets kliniska fas I-studie med ATOR-1015, bolagets huvudprojekt efter utlicensieringen av ADC-1013, en milstolpe som på sikt skulle kunna leda till en affär av minst samma dignitet som den med J&J.

Per Norlén, vd för Alligator Bioscience, vilken händelse vill du lyfta fram som den viktigaste för bolaget när du tittar tillbaka på 2018?
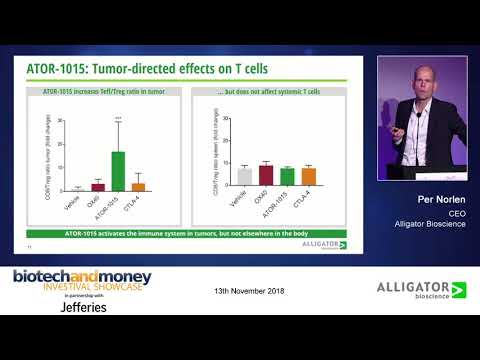
– Starten av den kliniska fas I-studien med ATOR-1015 är årets viktigaste milstolpe för Alligator. Vi är först i världen med ett nytt koncept, en tumörlokaliserande CTLA-4-antikropp, som vi tror kan vara lösningen på den enskilt största utmaningen inom immunonkologi idag, att göra CTLA-4-läkemedel tolerabla. Målmolekylen har sedan tidigare bekräftats effektiv men användningen av CTLA-4-blockerare har begränsats påtagligt av mycket svåra, ofta livshotande, biverkningar. ATOR-1015 ger genom sin förmåga att selektivt aktivera immunsystemet i tumören, men inte i resten av kroppen, en möjlighet att komma runt detta problem. Lösningen ligger i vårt bispecifika koncept där vi har skapat ett läkemedel som aktivt söker sig till tumörerna.
Vad tror du att detta kommer få för betydelse för er verksamhet?
– ATOR-1015 kan komma att förändra landskapet för framtida cancerbehandling. Biverkansprofilen som utvärderas i den nyligen startade kliniska fas I-studien kommer att vara mycket viktig, både vad gäller ATOR-1015:s fortsatta väg mot marknaden och för en framgångsrik utlicensiering. Vi kommer att ha etablerat säkerhetsdata om 18-24 månader, dvs fram emot mitten av 2020. Kan de resultat vi sett i prekliniska studier bekräftas i vårt kliniska utvecklingsprogram ger det oss en utmärkt position inför kommande diskussioner med potentiella partners.
»För nästa generations produkter har vi med vår teknologi byggt in funktioner som medför att molekylen inte är aktiv förrän den når tumören, vilket tar konceptet med tumörriktad immunterapi till en ny nivå och kan komma att bli avgörande för patienten«
Det första godkända immunterapi Yervoy godkändes 2011 av FDA och revolutionerade cancerforskningen. De bakomliggande rönen bakom Yervoy belönades också med årets nobelpris i medicin. Behandlingen ger dock många biverkningar. Ni utvecklar istället nästa generationens immunonkologiska läkemedel som selektivt aktiverar immunsystemet i tumören, men inte i resten av kroppen. Kan du utveckla hur era produkter skiljer sig från den första generationens immunterapier?
– Alligator är mycket riktigt differentierat jämfört de flesta andra immunonkologibolag genom vårt sätt att utveckla tumörriktade cancerläkemedel. Majoriteten av våra produkter är dubbelverkande, dvs aktiverar immunsystemet via två olika målmolekyler, dels för att rikta och öka effekten men även för att minimera biverkningar. För nästa generations produkter har vi med vår teknologi byggt in funktioner som medför att molekylen inte är aktiv förrän den når tumören, vilket tar konceptet med tumörriktad immunterapi till en ny nivå och kan komma att bli avgörande för patienten.
»ATOR-1015 kan komma att förändra landskapet för framtida cancerbehandling«
ATOR-1015 är bispecifik och binder dels, precis som Yervoy, till målproteinet CTLA-4, men även till receptorn OX40. Hur skiljer sig ATOR-1015 mot Yervoy vad gäller immunaktivering och biverkningar?
– Verkningsmekanismen är i grunden densamma, dvs ATOR-1015 och Yervoy aktiverar immunsystemet genom att blockera CTLA-4, och genom att slå ut regulatoriska T-celler. Det som skiljer sig åt är dels att Yervoy aktiverar immunsystemet systemiskt, i hela kroppen, medan ATOR-1015 främst aktiverar immunsystemet lokalt vid tumören, och dels genom att ATOR-1015 har en dubbelverkande funktion och möjlighet att ha ännu starkare klinisk effekt, i och med att den även aktiverar immunsystemet via OX40.
– Yervoys systemiska immunaktivering ger upphov till en lång rad svåra, ibland livshotande biverkningar. Vi har i prekliniska studier visat att ATOR-1015 anrikas i tumören efter att den administrerats via blodet och har starkare immunaktiverande effekt i tumören än i resten av kroppen. Min övertygelse är att denna egenskap kommer att bli avgörande och kan göra ATOR-1015 till det första läkemedlet som effektivt hanterar biverkningarna förknippade med målmolekylen CTLA-4. Detta vore ett stort steg framåt för hela området immunonkologi och för patienter med cancer.
CTLA-4 är sedan tidigare kliniskt validerad, inte minst genom Bristol-Myers Squibb arbete med Yervoy. Vad skulle du säga att det innebär för utvecklingsrisken i ATOR-1015-projektet?
– Det är oerhört positivt för oss att CTLA-4 är så väl validerat i patienter. Den kliniska utvecklingsplanen för ATOR-1015 kan helt riktas mot de patientpopulationer där man sett klinisk effekt med Yervoy, dvs malignt melanom, lungcancer, njurcancer och vissa former av kolorektalcancer. I den första kliniska studien kommer vi att definiera vilken dos vi ska gå vidare med och har sedan möjlighet att expandera med parallella studier i flera av ovanstående indikationer, som singelbehandling eller i kombination med PD-1.
Hur stor är marknadspotentialen för ett läkemedel med en CTLA-4-effekt utan biverkningar och hur förhåller sig ATOR-1015 till PD-1 som fortsatt ser ut att vara den primära standardbehandlingen?
– PD-1-hämmare kommer med all sannolikhet att dominera immunonkologin för överskådlig framtid, och övriga behandlingar bör i första hand ses som kombinationsprodukter som ges med PD-1. Där är CTLA-4 såvitt vi vet idag den klart viktigaste signalvägen. Yervoys försäljning uppgick 2017 till drygt 1 miljard dollar, och det baserades nästan uteslutande på användning mot malignt melanom som är en relativt liten cancerindikation. De svåra biverkningarna gör dessutom att endast 25 procent av melanompatienterna kan ta läkemedlet. ATOR-1015 har potential att dramatiskt öka den andelen. Om man till detta lägger att Yervoy även godkänts för behandling av lungcancer så ökar potentialen avsevärt. Kan vi visa att vårt koncept håller i kliniken kan man se försäljning på 1 miljard dollar som en bas, men med en potential som är långt större.
»Det är ett fantastiskt sammanträffande att detta årets Nobelpristagare i både medicin och kemi har en direkt koppling till ATOR-1015«
Om vi blickar framåt, vilka milstolpar kan vi förvänta oss för bolaget under 2019?
– Under 2019 är planen att vår samarbetspartner Janssen Biotech, Inc. kan ta läkemedelskandidaten ADC-1013 vidare till start av kombinationsstudier, och där vi fortfarande har en viss möjlighet att uppnå nästa milstolpsbetalning även om den mer troligt kommer under 2020. Den öppna kliniska studien med ATOR-1015 i cancerpatienter löper på under året. Vi kommer att se begynnande resultat utifrån säkerhet och tolerabilitet, och ha tydliga data på detta fram emot mitten av 2020. Vidare kommer vi att gå in i klinik med åtminstone ett projekt till, dvs ATOR-1017 där vi skickar in vår ansökan om klinisk prövning under sommaren 2019.
Vad ser du personligen mest fram emot under det kommande året?
– I första hand ser jag fram emot att följa de kliniska studierna med ADC-1013 och ATOR-1015.
 Avslutningsvis beskriver ni ATOR-1015 som ”Tre Nobelprisupptäckter i en och samma molekyl” i ert nyligen publicerade magasin på temat immunonkologi. Kan du utveckla detta?
Avslutningsvis beskriver ni ATOR-1015 som ”Tre Nobelprisupptäckter i en och samma molekyl” i ert nyligen publicerade magasin på temat immunonkologi. Kan du utveckla detta?
– Det är ett fantastiskt sammanträffande att detta årets Nobelpristagare i både medicin och kemi har en direkt koppling till ATOR-1015. James Allison och Tasuku Honjo tilldelades 2018 års nobelpris i medicin för deras upptäckt att cancer kan angripas genom att hämma immunförsvarets bromsmekanismer via CTLA-4 respektive PD-1, upptäckter som banat vägen för hela området immunonkologi. Alligators bispecifika läkemedelskandidat ATOR-1015, nästa generationens CTLA-4-antikropp, har sitt ursprung i Allisons ursprungliga upptäckter om detta målprotein.
– Men det är inte nog med det. George Smith, Frances Arnold, och Greg Winter tilldelades Nobelpriset i kemi. Arnold utvecklade en proteinoptimeringsteknologi som är besläktad med Alligators FIND-teknologi (Fragment INduced Diversity), och Smith och Winter utvecklade en fagdisplay-teknologi som används för att ta fram antikroppar med optimala egenskaper. ATOR-1015 är byggd och optimerad med hjälp av både fagdisplay och proteinoptimeringsteknologin FIND, och aktiverar immunsystemet via CTLA-4. Tre Nobelprisupptäckter i en och samma molekyl, vilket bör vara ett svårslaget rekord!
VD Per Norlén presenterade på LSX Investival konferens i London 13 november, dvs före beskedet att bolaget inlett klinisk fas I-studie med ATOR-1015:
Innehållet i Biostocks nyheter och analyser är oberoende men Biostocks verksamhet är i viss mån finansierad av bolag i branschen. Detta inlägg avser ett bolag som BioStock erhållit finansiering från. [et_bloom_inline optin_id=”optin_4″]

