
EMA öppnar upp för insyn i kliniska prövningar
Från och med 20 oktober offentliggör den europeiska läkemedelsmyndigheten EMA alla kliniska data som tillhandahållits av läkemedelsbolag i kliniska prövningar. Detta innebär att EMA blir den första stora tillsynsmyndigheten som gör kliniska data tillgängliga för allmänheten i någon större utsträckning. Det betyder också att läkemedelsbolagen från och med nu måste finna sig att i alla resultat från deras kliniska prövningar – undantaget direkt affärskritiska delar – blir offentliga när de ansöker om marknadsgodkännande. Med denna transparenskampanj hoppas EMA bland annat kunna bidra till en positiv utveckling av de medicinska vetenskaperna där forskarna kan lära av sina kollegors misstag, samt att öka allmänhetens förtroende för myndighetens godkännande- och granskningsprocesser.
EMA inledde på torsdagen med att publicera data från över hundra kliniska rapporter rörande två EMA-godkända läkemedel, cancerläkemedlet carfilzomib och giktbehandlingen lesinurad, omfattandes totalt cirka 260.000 sidor. Det markerade starten för en ny öppenhetspolicy som gör EMA till den första stora tillsynsmyndigheten för läkemedelsprövningar att publicera alla resultat av kliniska studier som lämnas in när läkemedelsbolagen ansöker om marknadsföringsgodkännande. Policyn omfattar såväl godkända som avvisade ansökningar och även läkemedel vars tillstånd har återkallats. De kliniska data som kommer att publiceras inkluderar både positiva och negativa studieresultat, samt eventuella uppgifter om läkemedelsbiverkningar.
Genom att proaktivt publicera kliniska data vill EMA dels hjälpa till med att undvika att kliniska prövningar dupliceras, dels främja innovation och stimulera utvecklingen av nya läkemedel. Ett viktigt syfte är också att öka allmänhetens förtroende för EMAs vetenskapliga- och beslutsprocesser, samt att underlätta för akademiker och forskare att själva granska företagens uppgifter om säkerhet och effekt av nya läkemedel. Sist men inte minst ges patienterna som tar läkemedlen en möjlighet till insyn i underliggande studiedata rörandes de behandlingar de själva genomgår.
Dessa kliniska studierapporter är betydligt mer detaljerade än de s.k “papers” som läkemedelsbolagen publicerar i vetenskapliga tidskrifter. En undersökning i PLoS Medicine har visat att dessa rapporter ofta är ofullständiga, trots att de ger intryck av att vara mycket omfattande.
Enligt analysen i PLoS Medicine saknas ofta avgörande variabler och resultat såsom dödlighet och allvarliga biverkningar i publicerade data, det kan också gälla uppgifter om depressionssymptom i kliniska försök med t.ex. antidepressiva läkemedel, samt detaljer om hjärtinfarkt och stroke i diabetesläkemedelsprövningar. Att offentliggöra sådana specifika detaljer bör kunna inverka positivt på framtida läkemedelsutveckling.
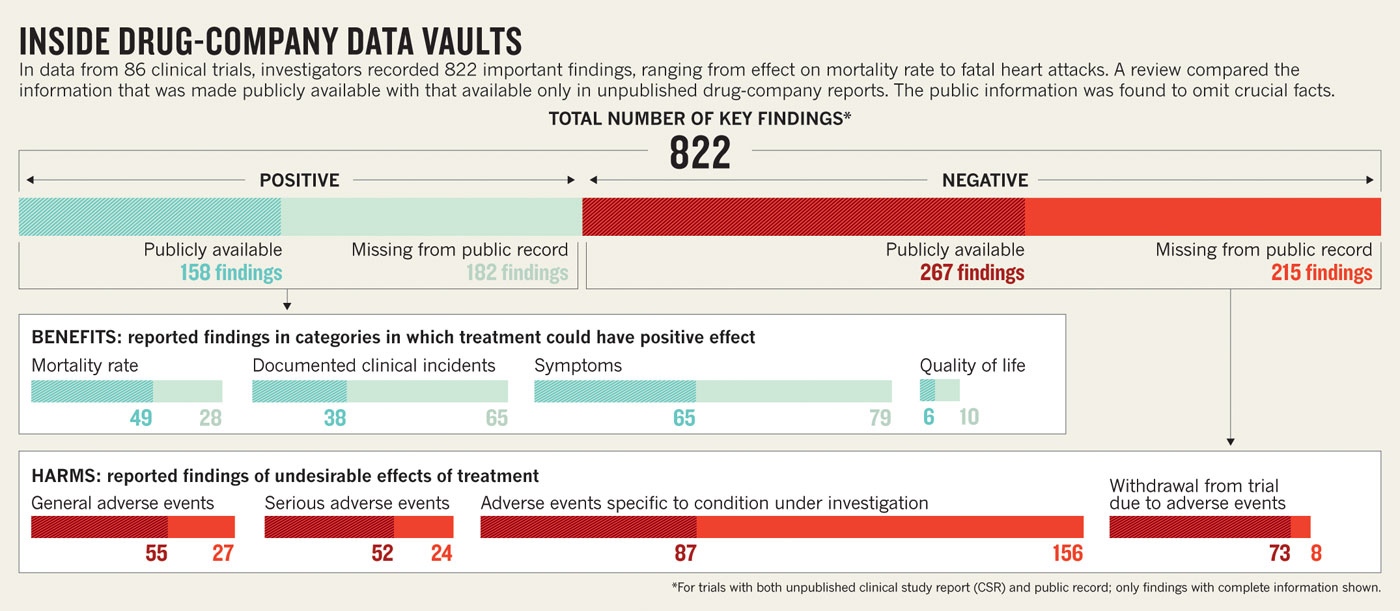
Nedan en översikt som visar att av 822 viktiga rön, såväl positiva som negativa, som insamlats i 86 kliniska studier rörande allt från effektivitet till mortalitet och antalet hjärtattacker med dödlig utgång, hade endast ungefär hälften (425) offentliggjorts.
Klicka på bilden för en förstoring.
Transparensen hyllas av lobbygrupp
Patienter och läkare har väntat länge på att få ta del av data från kliniska prövningar, menar Yann Le Cam på patientlobbygruppen EURORDIS-Rare Diseases Europe, en organisation som ingår i EMA:s styrelse. Cirka 700 medicinska och patientorganisationer har lobbat för att dessa data ska släppas fria, under överinseende av AllTrials-kampanjen som startades just av denna orsak. AllTrials företrädare är mycket nöjda med EMA:s beslut och hoppas nu att fler läkemedelsmyndigheter kommer att följa efter.
Lovvärt, men uddlöst när det gäller äldre läkemedel
EMA kommer att offentliggöra alla kliniska studierapporter som lämnats in efter den 1 januari 2015, oavsett om de avser ansökningar som har godkänts, avvisats eller läkemedel som återkallats. De flesta läkemedel som används idag godkändes dock innan denna deadline, vilket innebär att den stora förändringen alltså främst kommer att beröra framtida läkemedel. Målet är att ge allmänheten tillgång till cirka 4500 kliniska prövningar varje år, rensade på kommersiell konfidentiell information samt med garanterad patientsekretess i enlighet med EU:s komplexa dataskyddsregler. De bolag vars läkemedel berörs kommer också att kontaktas av myndigheten innan deras material läggs ut.
I mars i år publicerade EMA riktlinjer bland annat för hur läkemedelsbolagen kan anonymisera data, samt hur de kan ansöka om att få vissa delar i sina ansökningar borttagna, och så sent som förra månaden fick EMA överklaga två interima domstolsbeslut från Europadomstolen som syftar till att blockera offentliggörande av kliniska rapporter från PTC Therapeutics och Intervet. Så sista ordet är nog inte sagt ännu gällande denna omfattande policyförändring som i allra högsta grad berör slutkonsumenten, patienten. EU:s läkemedelsmyndighet övergripande ansvar är dock att skydda och främja folkhälsan, varför detta beslut är ett logiskt steg för EMA att ta.
Läs mer om beslutet från EMA
Databasen med kliniska data kan nås här



